| Nom | Calcium 40 |
|---|---|
| Symbole |
40 20Ca 20 |
| Neutrons | 20 |
| Protons | 20 |
| Présence naturelle | 96.94(16) %[1] |
|---|---|
| Demi-vie | Stable |
| Masse atomique | 39,962590851(22) u |
| Spin | 0+ |
| Excès d'énergie | −34 846,402 ± 0,020 keV[1] |
| Énergie de liaison par nucléon | 8 551,305 ± 0,001 keV[1] |
| Isotope parent | Désintégration | Demi-vie |
|---|---|---|
| 40 19K |
β− | 1,248 × 109 ans |
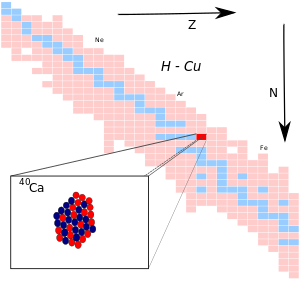
Le calcium 40, noté 40Ca, est l'isotope du calcium dont le nombre de masse est égal à 40 : son noyau atomique compte 20 protons et 20 neutrons avec un spin 0+ pour une masse atomique de 39,962 591 g/mol. Il est caractérisé par un excès de masse de −34 846,4 keV et une énergie de liaison nucléaire par nucléon de 8 551,305 ± 0,001 keV[1]. Le calcium naturel en contient 96,941 %.
Le noyau de 40Ca est remarquable dans la mesure où il est constitué d'un nombre magique à la fois de protons et de neutrons ; il est donc doublement magique. C'est un noyau stable, bien qu'en relatif déficit de neutrons. C'est par ailleurs un nucléide α, composé de dix particules α, susceptible d'être produit par des réactions α lors de la nucléosynthèse dans des étoiles suffisamment massives.
40Ca est un produit de désintégration du potassium 40, 40K :
Cette réaction illustre bien l'importance de la parité des nombres de protons et de neutrons dans la stabilité d'un noyau léger : avec 20 protons et 20 neutrons et malgré son déficit de neutrons, le 40Ca est plus stable que le 40K, qui compte 19 protons et 21 neutrons et n'a donc aucun déficit de neutrons ; l'argon 40, avec 18 protons et 22 neutrons est également plus stable que le potassium 40.
Le calcium 48 est l'autre isotope doublement magique du calcium (20 protons et 28 neutrons), avec une abondance naturelle de seulement 0,187 % bien qu'il soit quasi stable.
-
(en) « Live Chart of Nuclides: 40
20Ca
20 », sur www-nds.iaea.org, AIEA, (consulté le ).